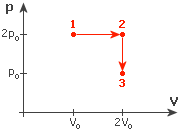
 N moli idealnego gazu o temperaturze początkowej T poddano przemianom (rysunek). Jaką pracę wykonał gaz przy przejściu ze stanu 1 do 3? N moli idealnego gazu o temperaturze początkowej T poddano przemianom (rysunek). Jaką pracę wykonał gaz przy przejściu ze stanu 1 do 3?
|
T
N
W = ?
1. Równanie Clapeyrona
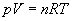
2. Praca gazu idealnego
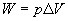
|
|
|
 Zanim do czegokolwiek się zabierzemy, spójrzmy na wykres. Wprawnym okiem można zauważyć, iż przy przejściu gazu ze stanu 1 do stanu 2 nie zmienia się ciśnienie, a przy przejściu ze stanu 2 do stanu 3 stała jest objętość. Oznacza to, że w przypadku stanu 1-2 mamy do czynienia z przemianą izobaryczną, a w stanach 2-3 izochoryczną.
Zanim do czegokolwiek się zabierzemy, spójrzmy na wykres. Wprawnym okiem można zauważyć, iż przy przejściu gazu ze stanu 1 do stanu 2 nie zmienia się ciśnienie, a przy przejściu ze stanu 2 do stanu 3 stała jest objętość. Oznacza to, że w przypadku stanu 1-2 mamy do czynienia z przemianą izobaryczną, a w stanach 2-3 izochoryczną.
Całkowita praca gazu przy przejściu ze stanu 1 do 3 to suma prac przejścia do poszczególnych stanów:
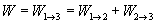
Zajmijmy się najpierw przemianą izobaryczną. Gaz nie zmienia swojego ciśnienia, zgodnie więc ze wzorem na pracę:

Przyjrzymy się teraz przemianie izochorycznej. Zauważ, że gaz przechodząc ze stanu 2 do stanu 3 nie zmienia swojej objętości - stąd ΔV = 0. Oznacza to, że praca wykonana przez gaz w tej przemianie wynosi zero.
Całkowita praca wynosi więc:
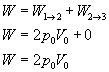
Niby wszystko fajnie, ale jak zapisać nasz wynik w postaci danych, które mamy w zadaniu, czyli N i T? Przydać nam się może do tego równanie Clapeyrona, które to sobie zapiszemy dla stanu 1 naszego gazu (bo dla tego stanu mamy podaną temperaturę T).
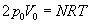
gdzie R to stała gazowa (do znalezienia w tablicach).
Porównując dwa powyższe wzory otrzymamy, że:
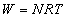
Gaz przy przejściu ze stanu 1 do stanu 3 wykonał pracę NRT.Jamnik
« powrót do listy zadańZnalazłeś błąd w materiale? Skontaktuj się z nami, przysyłając adres strony, na której znajduje się błąd i informację o tym, czego dotyczy błąd.
