Całkowita energia cząsteczek (atomów) gazu jest sumą energii kinetycznych tych cząsteczek (cząsteczki gazu doskonałego nie posiadają energii potencjalnej). Dla gazu zamkniętego w zbiorniku ta energia całkowita jest stała:
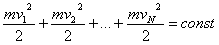 Ponieważ masy cząsteczek danego gazu są jednakowe, więc suma kwadratów prędkości jest stała:
Ponieważ masy cząsteczek danego gazu są jednakowe, więc suma kwadratów prędkości jest stała:
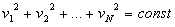 Dzieląc to równanie przez liczbę cząsteczek otrzymamy wartość średniego kwadratu prędkości:
Dzieląc to równanie przez liczbę cząsteczek otrzymamy wartość średniego kwadratu prędkości:
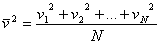 Mając taką prędkość, możemy ogromnej liczbie cząsteczek o bardzo różnych prędkościach i energiach w rzeczywistości przypisać jedną średnią wartość energii kinetycznej:
Mając taką prędkość, możemy ogromnej liczbie cząsteczek o bardzo różnych prędkościach i energiach w rzeczywistości przypisać jedną średnią wartość energii kinetycznej:
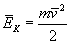 Powyższy wzór jest mało wygodny do obliczania średniej energii kinetycznej, gdyż wyliczenie średniej prędkości jest bardzo trudne. Dlatego stosujemy drugi wzór na średnią energię kinetyczną (a przyrównując oba, możemy wyliczyć np. średnią prędkość cząsteczek w zbiorniku).
Powyższy wzór jest mało wygodny do obliczania średniej energii kinetycznej, gdyż wyliczenie średniej prędkości jest bardzo trudne. Dlatego stosujemy drugi wzór na średnią energię kinetyczną (a przyrównując oba, możemy wyliczyć np. średnią prędkość cząsteczek w zbiorniku).
Znany nam wzór na wartość ciśnienia gazu doskonałego w zbiorniku (podstawowy wzór teorii kinetyczno-molekularnej gazów)...
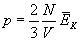 ...przekształcamy w następujący sposób:
...przekształcamy w następujący sposób:
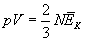 gdzie:
gdzie:
N - liczba cząsteczek gazu w zbiorniku,
p - ciśnienie gazu,
V - objętość gazu.
Z równania Clapeyrona wiemy, że:
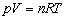 Wiadomo też, iż:
Wiadomo też, iż:
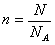 gdzie:
gdzie:
n - liczba moli gazu,
NA - liczba Avogardo,
R - stała gazowa.
Reasumując, otrzymamy:
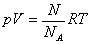 Nadszedł czas by przyrównać podstawowy wzór teorii kinetyczno-molekularnej gazów z równaniem Clapeyrona
Nadszedł czas by przyrównać podstawowy wzór teorii kinetyczno-molekularnej gazów z równaniem Clapeyrona
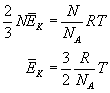 Definiujemy również stałą Boltzmanna k jako
Definiujemy również stałą Boltzmanna k jako
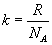 Zatem:
Zatem:
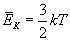
Średnia energia kinetyczna gazu doskonałego zależy jedynie od temperatury gazu i jest do niej wprost proporcjonalna.
Wartości stałych k, R i NA znajdziecie w każdych tablicach.« powrót do listy wyprowadzeńZnalazłeś błąd w materiale? Skontaktuj się z nami, przysyłając adres strony, na której znajduje się błąd i informację o tym, czego dotyczy błąd.
